Una de las más viejas herramientas tecnológicas de la Humanidad
es también un interesantísimo y espectacular fenómeno químico
que nos introduce en las leyes de la termodinámica,
la física cuántica y la naturaleza de la entropía y el tiempo.

Todos lo conocemos, casi todos nos hemos quedado hipnotizados viéndolo arder alguna vez. Desde la humilde cerilla o el hogar que da nombre a nuestras guaridas hasta las erupciones volcánicas, las tormentas ígneas de los grandes desastres naturales o humanos y las inmensas llamaradas del Sol, monumentales como muchos planetas Tierra, el fuego está ahí desde que hubo un ahí. Hasta cierto punto, se puede decir que este universo surgió con una gran ignición. ¿Qué es el fuego? ¿Por qué calienta e ilumina? Y, ¿de qué modos distintos llegó a sernos tan útil en nuestra evolución final?
De la naturaleza del fuego.
En realidad, las llamaradas solares o el Big Bang no son fuego en sentido estricto, sino fenómenos físicos de naturaleza distinta que sólo coinciden con él en que son capaces de emitir luz y calor. Hoy vamos a centrarnos en lo que los humanos hemos conocido como fuego desde tiempo inmemorial: esa cosa fantasmal que arde ante nuestros ojos con llamas bailarinas y nos calienta, nos ilumina y nos quema.
En principio, el fuego es un fenómeno químico bastante sencillo: rigurosamente hablando, consiste en la oxidación rápida y exotérmica de la materia mediante el proceso denominado combustión, aunque no haya llama ni humo ni ninguna de sus otras características más visibles. Vamos a ver lo que significa esto.
Una parte significativa de los átomos y moléculas que componen la realidad material que conocemos pueden combinarse con el oxígeno del aire, del agua o de cualquier otro lugar para producir óxidos. Aquí tenemos que quitarnos una idea preconcebida de la cabeza: la herrumbre u orín que vemos en los metales oxidados no es el óxido, sino sólo un tipo de óxido. Hay muchísimos más, que no tienen ese aspecto ni parecido. El agua, por ejemplo, es un óxido. H2O, ¿recuerdas? Dos átomos de hidrógeno primordial combinados con uno de oxígeno estelar. De hecho, se puede llamar sistemáticamente al agua monóxido de dihidrógeno (y también ácido hidroxílico y de otras maneras), lo que ha dado lugar a una deliciosa broma pedagógica que aprovecha el temor de mucha gente a todo lo que suene a química. Nuestro propio organismo está lleno de óxidos muy distintos desempeñando un montón de funciones biológicas, como por ejemplo en la respiración de cada una de nuestras células.

En realidad, la oxidación puede darse con cosas que no son oxígeno; pero la que se da con oxígeno es muy común y la primera que se descubrió, hasta el punto de darle nombre a todo el fenómeno. Hay óxidos naturales y artificiales por todas partes, pues se trata de una de las reacciones más corrientes de la química que nos formó y nos mantiene aquí.
Cuando esta reacción de oxidación produce energía en forma de calor, siguiendo las leyes de la termodinámica química, decimos que es exotérmica y la llamamos combustión. La combustión puede ser muy lenta o muy rápida, y en ella siempre hay una sustancia que actúa de combustible y otra que actúa de oxidante o comburente. Como vivimos en la corteza de un mundo donde el oxígeno está bastante presente hoy en día, este oxígeno resulta ser el comburente más común a nuestro alrededor.
El combustible puede ser cualquier materia capaz de combinarse con el oxidante o comburente emitiendo calor en el proceso. Algunos de los combustibles más eficaces que existen se basan en el carbono, también muy abundante en la Tierra. De manera muy significativa, está presente en todo lo que vive (la vida en la Tierra está sustentada completamente en el carbono) o estuvo vivo alguna vez, desde la leña hasta el carbón o el petróleo y el gas natural. No en vano estas últimas sustancias se denominan hidrocarburos; es decir, compuestos de carbono e hidrógeno, que oxidan –se queman– muy bien con el oxígeno.
Nuestro propio cuerpo, muy rico en compuestos del carbono, sería un buen combustible si no fuera porque el 45-75% de agua que contiene tiende a detener la combustión (apagarla). El agua tiende a detener la combustión porque ya está quemada (oxidada); por tanto, no puede arder y además se mete por medio, bloquea y enfría la oxidación del resto de las sustancias que impregna. Este es el motivo de que, mal que les pese a muchos, el motor de agua no pueda ser.
El proceso de la combustión produce una o varias sustancias que incorporan los componentes del combustible y el comburente, aunque reorganizados de una manera distinta. Estas sustancias pueden ser de muchos tipos, pero las más conocidas son el sólido que llamamos ceniza (aunque, por ejemplo, podríamos considerar también al agua como una ceniza fría de hidrógeno y oxígeno) y una serie de componentes gaseosos que escapan en forma de llama y humo (el humo también suele arrastrar una parte de las cenizas más volátiles). La llama y el humo pueden ser visibles o invisibles por completo al ojo desnudo, según las propiedades de cada combustión en particular. Estas sustancias, si han ardido por completo, ya no pueden volverse a usar como combustible o comburente porque han completado la reacción y no les queda energía química para ceder.
En el corazón de la llama.
Como dije más arriba, la combustión puede ser muy lenta o muy rápida. Cuando es muy rápida, puede llegar a convertirse en una deflagración; y si es tan veloz que genera una onda de choque supersónica, entonces hablamos de detonación o explosión (aunque no todas las explosiones son el resultado de este tipo de reacción). Por ejemplo, la combustión muy rápida de un hidrocarburo del tipo de la gasolina con el oxígeno del aire en un motor de combustión interna –como en un coche o una moto– provoca una deflagración que mueve el pistón y con él al resto del motor.
Funcionamiento de un motor de combustión interna.
La ignición de una mezcla de hidrocarburos y oxígeno atmosférico
aporta la energía necesaria para moverlo.
Cuando la combustión es moderadamente rápida pero no tanto, entonces nos encontramos con el fuego que conocemos como tal. Y su parte más llamativa y fascinante es, naturalmente, la llama. La llama está compuesta por los gases calientes y las cenizas más volátiles que son resultado de la combustión y se alejan de la misma siguiendo principios físicos corrientes como la convección y las leyes que gobiernan el comportamiento de los gases.

Pero, ¿por qué brilla y calienta? Si no quisiéramos profundizar, podríamos decir simplemente que los objetos calientes emiten energía en forma de calor y luz, punto. Lo llamamos calor e incandescencia, y la mayoría de la gente se conforma con eso, pero nosotros no. ¿De qué forma una reacción química como la combustión puede producir luz y calor?
Cuando un cuerpo –sólido, líquido, gaseoso, lo que sea– aumenta su temperatura, es porque los átomos y moléculas que lo forman se han excitado. Un átomo desexcitado por completo estaría en estado fundamental y se hallaría a la mínima temperatura posible: aproximadamente 273,15ºC bajo cero, lo que llamamos el cero absoluto. Por eso esta es la temperatura más baja posible en nuestro universo: nada puede estar más inmóvil que quieto por completo, ni tener menos energía que ninguna energía en absoluto.
Sin embargo, el cosmos está lleno de energía capaz de provocar excitación y no hay nada en él que esté o pueda llegar al cero absoluto teórico: lo impide la Tercera Ley de la Termodinámica. Hasta el espacio profundo, vacío casi por completo, viene a estar a unos 270 grados bajo cero. Esos tres grados de diferencia (2'725 para ser exactos) se los aporta la radiación del fondo cósmico, que es resultado del Big Bang que nos fundó y omnipresente a este lado de la realidad. En los laboratorios humanos, con técnicas muy sofisticadas, se ha logrado alcanzar la friolera –literalmente– de cien billonésimas de grado por encima del cero absoluto. Y sin embargo, no es el cero absoluto. Todo lo que existe en este universo está en algún grado de excitación, aunque sea ínfimo.
En el momento en que algo está excitado, por poco que sea, decimos que se encuentra a una determinada temperatura; y además, puede transferir una parte de esa energía que lo mantiene excitado a otros cuerpos. Esta transferencia es lo que llamamos calor, y constituye uno de los mecanismos más esenciales mediante los que funciona la realidad. Sin calor, no habría entropía y este universo permanecería eternamente congelado en un absurdo estado inicial sin posibilidad alguna de variar hacia ningún otro estado; y, por tanto, desprovisto también de tiempo. Estaríamos ante un universo fallido. Por eso la Termodinámica es tan importante. Pero, ¿cómo pasa el calor a estos otros cuerpos, como por ejemplo nuestra piel, para que podamos sentir el calorcito de la hoguera (o el calor del Sol a través del vacío cósmico, de tal modo que la vida pueda existir)? ¡Ah! Aquí ya tenemos que profundizar un poquito más y adentrarnos en los valles extraños de la mecánica cuántica.
Calor cuántico.

Una de las proposiciones más esenciales de la física cuántica dice que, en la escala de lo muy pequeño, la realidad no funciona de manera suave y continua sino abruptamente, a saltos entre distintos estados. Esto es: las cosas no ocurren de manera lineal, sino de cuanto en cuanto. Sí, exactamente por ese motivo se llama física cuántica; imaginativa que es la gente.
Entre otras cosas, los átomos que componen la materia están formados por dos partículas cargadas: el protón, con carga positiva, y el electrón, con carga negativa (más el neutrón, que no viene a cuento ahora). Estas partículas son lo bastante pequeñas para comportarse de manera cuántica. Particularmente, el electrón sólo puede existir en unos determinados orbitales alrededor del núcleo atómico (donde están los protones y neutrones). Es decir: o está en uno o está en otro, pero no está en el medio, ni pasa por el medio, ni nada parecido. Sí, ya, no es nada intuitivo eso de que algo pueda ir del punto A al punto B sin pasar por el camino intermedio (aunque, para empezar, el electrón existe como una nube de probabilidad con incertidumbre cuántica, o sea que ya te puedes hacer una idea de cómo va esto...).
Cuando un átomo es excitado (se calienta), sus electrones comienzan a saltar de cuanto en cuanto hacia orbitales cada vez más exteriores; si se excita mucho, terminarán por perderse y diremos que está ionizado. Cuando empieza a enfriarse, estos electrones –si no han escapado– retornan hacia los orbitales inferiores. Y aquí está el secreto: cada vez que un electrón salta a un orbital exterior lo hace porque absorbe un fotón, y cada vez que vuelve a uno inferior emite un fotón. Es decir: cuando algo se calienta absorbe fotones (de la radiación térmica circundante), pero en el momento en que empieza a enfriarse los emite hacia el exterior.
Habiendo fotones de por medio, estamos ante radiación electromagnética. El calor, la interacción más esencial de este universo, la que permite la entropía y el tiempo, se vehicula mediante esta forma de radiación electromagnética que llamamos radiación térmica, compuesta por estos fotones. Cuando un átomo recibe y absorbe fotones, sus electrones marchan a orbitales exteriores salto fotónico a salto fotónico: así es como se excita, se calienta. Y en cuanto comienza a enfriarse, de vuelta hacia un estado más fundamental, sus electrones (si no se han perdido) regresan también salto fotónico a salto fotónico, emitiendo uno cada vez. Por tanto, cuando un átomo recibe radiación térmica absorbe fotones y se calienta; y cuando se enfría, los vuelve a emitir, lo que calentará a su vez a otros átomos situados a su alrededor. Este fenómeno es uno de los campos de estudio fundamentales de la electrodinámica cuántica.
Por eso el fuego calienta. Por eso el Sol calienta. Por eso el universo está caliente y tiene entropía y tiempo. Por eso, también, tu cuerpo está caliente y es capaz de calentar. Lo hacen estos humildes, minúsculos fotones saltando de átomo en átomo cada vez que un electrón cambia de orbital. Desde el inicio del tiempo y para siempre jamás.
De la luz multicolor y la física cuántica.

Este fenómeno de la electrodinámica cuántica explica por qué el calor se transfiere de unos cuerpos a otros: es obra de la radiación electromagnética térmica, a una frecuencia situada generalmente en el rango de los infrarrojos. Por eso, las cámaras que pueden ver en el infrarrojo detectan los cuerpos calientes.
¿Y la luz? Bueno, en apariencia la respuesta debería ser fácil: la luz no es más que esta misma radiación electromagnética a mayor frecuencia. Diríamos –y creíamos antiguamente– que, conforme aumenta la temperatura, los electrones brincan cada vez más rápido, los fotones se emiten a frecuencia mayor y la emisión térmica va desplazándose hacia el rango de la luz visible e incluso el ultravioleta –que son también radiación electromagnética, sólo que a una frecuencia superior–. Así, se pasaría de proyectar calor a emitir asimismo luz y...
...y tenemos un problema. No te supondrás que iba a ser tan sencillo, ¿no? 😀
En apariencia debería ser así. Pero ya hemos visto que esto de la cuántica se comporta de maneras extrañas. Cuando un objeto sólido se calienta lo bastante, en efecto, la frecuencia de la radiación electromagnética que emite aumenta y pasa del infrarrojo a las regiones inferiores de la luz visible de color rojo: decimos que está al rojo vivo. Si se calienta aún más, la frecuencia sigue subiendo y va pasando a proyectar luz amarilla, después blanca (cuando decimos que está al blanco) y finalmente azul. Esto estaba ya estudiado a finales del siglo XIX: la Ley de Desplazamiento de Wien definía la frecuencia a la que la radiación es mayor para cada temperatura determinada y la potencia total emitida quedaba determinada por la Ley de Stefan-Boltzmann. Todo controlado, ¿eh?
Va a ser que no. Porque si la temperatura sigue aumentando, lógicamente la frecuencia tendría que seguir aumentando hacia el ultravioleta. Y en ese momento debería volverse invisible, puesto que el ojo humano no puede ver la radiación ultravioleta. Sin embargo, esto no ocurre: por muy caliente que esté un cuerpo, sigue siendo visible con su brillo blanquiazul hasta que se consume por completo, si es que se consume. ¡Oops! Parece que tenemos un problema aquí.
A principios del siglo XX, se intentó resolver este problema mediante la Ley de Rayleigh-Jeans. Y funcionaba bien, pero sólo hasta cierto punto, pues lamentablemente predecía que un cuerpo que estuviera en condiciones de equilibrio térmico con el ambiente circundante emitiría... energía infinita. Ajá, infinita. Como a todas luces esto no sucede en la realidad, sino más bien todo lo contrario (la luminosidad y por tanto la energía emitida por los objetos calientes comienza a reducirse a partir de cierta temperatura, mientras que el color se queda estancado en el azul), significa que toda nuestra comprensión de cómo funciona el mundo estaba mal de alguna manera muy retorcida: estábamos ante una violación mayor de las leyes físicas conocidas en su tiempo, la llamada catástrofe ultravioleta.
No te lo vas a creer: hubo que descubrir un nuevo ámbito de comprensión de la realidad para darle explicación. Este es ni más ni menos el origen de la física cuántica, o casi.
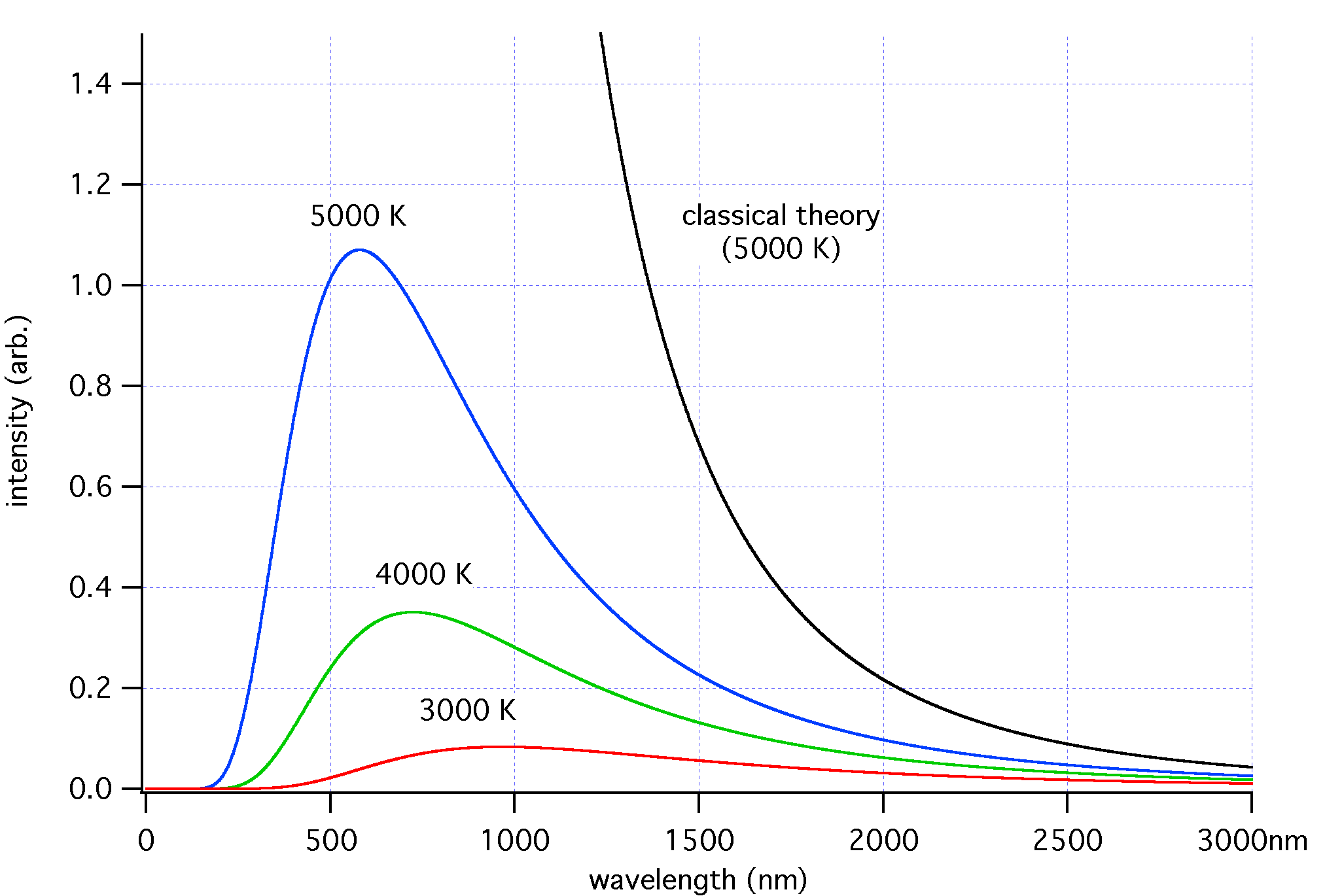
Fue el supuestamente poco cuántico Einstein quien propuso aplicar la Ley de Planck, primera de la mecánica cuántica, para resolver este rompecabezas cósmico por fin. Y funcionó. Si la energía térmica emitida no lo hace de manera continua, sino en paquetes discretos –los condenados cuantos– con una energía proporcional a la frecuencia, entonces todo vuelve a tener sentido. Pues en el modelo clásico, esta energía quedaba distribuida uniformemente a lo largo de todo el rango de emisión y terminaba acumulándose hasta el infinito; mientras que en el modelo cuántico sólo lo hace en unos modos específicos, correspondientes a estos estados cuánticos discretos.
Dicho de otra manera: la energía electromagnética no sigue la descripción lineal clásica, sino que sólo puede oscilar o emitirse en paquetes discretos (cuantos) de energía proporcional a la frecuencia. Como resultado, el número de modos posibles para una energía determinada en oscilación a alta frecuencia se reduce, y con ella la energía promedio a tales frecuencias. Finalmente, la potencia radiada cae a cero y la potencia total emitida es finita (no infinita, como predecía la física clásica y obviamente no podía ser). Así, la Ley cuántica de Planck describe lo que sucede exactamente en la realidad.
Estos paquetes o cuantos de energía radiada se llaman fotones. Y así fue como comenzamos a comprender profundamente no sólo la luz y el calor, sino también la entropía y el tiempo que rigen nuestra existencia y evolución.
Fuego sobre la Tierra.
Los primeros indicios fósiles del fuego que conocemos en el planeta Tierra surgen con la aparición de las plantas terrestres, fuera del mar, hace unos cuatrocientos setenta millones de años. Antes de eso, no había muchas cosas que pudieran arder fuera del agua; y dentro del agua, las cosas arden fatal. Pero, sobre todo, la presencia de estas plantas aéreas incrementaron enormemente la presencia de oxígeno en la atmósfera. Cuando el oxígeno libre en el aire pasó del 13%, empezaron a producirse los primeros incendios forestales por las causas naturales corrientes, consumiendo parte de esta flora que había salido del mar. Dada su poca densidad y altura, no se piensa que estos incendios fueran muy espectaculares. Sin embargo, su combustión lenta comenzó a producir carbón vegetal; y este carbón vegetal nos informa de la presencia del fuego antiguo sobre la faz de nuestro planeta desde por lo menos el Silúrico.
No fue hasta la aparición de los grandes bosques, en el Devónico, cuando comenzaron a ocasionarse importantes incendios forestales. Sin embargo, hay que esperar hasta el Carbonífero –con mucha biomasa terrestre y mucho oxígeno aéreo– para ver fuegos a gran escala capaces de formar relevantes yacimientos de carbón (y hasta el 20% del carbón formado por este procedimiento es carbón vegetal fosilizado, lleno de evidencias y pistas sobre la larga evolución de la vida en el planeta Tierra).

Hacia finales del Pérmico, durante el Gran Morir, los niveles de oxígeno atmosférico cayeron acusadamente y con ellos el número e intensidad de los fuegos; a principios del Triásico parece haber una significativa carencia de producción de carbones en la Tierra, lo que nos invita a pensar en una biomasa muy reducida tras la gran extinción. El fuego vuelve a hacer aparición con fuerza entre el Jurásico y el Cretácico. No obstante, la imaginería popular sobre un infierno global durante la extinción que se cargó a los dinosaurios es infundada: no hay indicios de que los incendios fueran más fuertes o extensos en este periodo que en los inmediatamente anteriores o posteriores.
Los custodios del fuego.
El fuego, por tanto, era un fenómeno generalizado y corriente cuando los primeros humanos aparecimos por aquí. Y desde el principio, estuvo vinculado a nuestra historia, con hondos significados simbólicos, religiosos, filosóficos y –por supuesto– de orden práctico.
Existen indicios de la presencia del fuego en las comunidades humanas, y quizás un cierto dominio del mismo, desde hace aproximadamente un millón y medio de años. En el yacimiento de Chesowanja (Kenia), poblado por homo erectus, se han encontrado restos de una especie de cerámica primitiva cocida a una temperatura de entre doscientos y cuatrocientos grados; no obstante, se trata de pruebas inconcluyentes. Por el contrario, no cabe la menor duda sobre su uso generalizado a partir del rango de los 200.000-400.000 años, y de hecho es uno de los elementos fundamentales para distinguir entre las culturas del Paleolítico Inferior y las del Paleolítico Medio.
El control del fuego aportó cambios significativos al comportamiento humano. Su calor y su luz nos permitió adentrarnos en lugares más fríos y en el corazón de la noche, ayudó a espantar animales peligrosos o molestos y mejoró nuestra nutrición mediante la ingesta de proteínas cocinadas. Richard Wrangham, de la Universidad de Harvard, piensa que el cocinado de determinados tubérculos permitió la evolución de dientes más pequeños y cerebros más grandes, junto a un aporte de energía adicional que nos dio alas para salir a cazar más a menudo.
En realidad, son incontables las cosas que el dominio del fuego hizo por nosotros, empujándonos constantemente hacia adelante por la senda de la humanidad y la civilización. El fuego es, seguramente, la tecnología estrella de la especie humana. Sin él, nunca habríamos desarrollado la cerámica, la metalurgia o cualquier otra tecnología capaz de sacarnos del Paleolítico, por no mencionar la electricidad, el motor de combustión interna, el vuelo aeroespacial o... la física cuántica, por ejemplo. También ha sido, con frecuencia, un destructor de civilización por vías accidentales o violentas; y hasta de esa destrucción surgieron más cosas nuevas. El fuego viaja con nosotros desde que empezamos a ser lo que somos; y seguirá acompañándonos en nuestro camino, bajo cualquiera de sus formas, por siempre jamás.

Comentarios
<% if(canWriteComments) { %> <% } %>Comentarios:
<% if(_.allKeys(comments).length > 0) { %> <% _.each(comments, function(comment) { %>-
<% if(comment.user.image) { %>
![<%= comment.user.username %>]() <% } else { %>
<%= comment.user.firstLetter %>
<% } %>
<% } else { %>
<%= comment.user.firstLetter %>
<% } %>
<%= comment.user.username %>
<%= comment.published %>
<%= comment.dateTime %>
<%= comment.text %>
Responder
<% if(_.allKeys(comment.children.models).length > 0) { %>
<% }); %>
<% } else { %>
- No hay comentarios para esta noticia.
<% } %>
Mostrar más comentarios<% _.each(comment.children.models, function(children) { %> <% children = children.toJSON() %>-
<% if(children.user.image) { %>
![<%= children.user.username %>]() <% } else { %>
<%= children.user.firstLetter %>
<% } %>
<% } else { %>
<%= children.user.firstLetter %>
<% } %>
<% if(children.parent.id != comment.id) { %>
en respuesta a <%= children.parent.username %>
<% } %>
<%= children.user.username %>
<%= children.published %>
<%= children.dateTime %>
<%= children.text %>
Responder
<% }); %>
<% } %> <% if(canWriteComments) { %> <% } %>